Giáo án Hóa học Lớp 8 - Tiết 50+51, Bài 9: Muối
TIẾT 50 + 51. BÀI 9. MUỐI
I. Mục tiêu
1. Kiến thức
- Nêu được tính chất hóa học của muối.
2. Kĩ năng
- Viết được PT minh họa. Giải bài toán tính theo PTHH.
3. Thái độ
- Giáo dục HS ý thức học tập tích cực
II. Chuẩn bị
1. Giáo viên: máy tính, chia sẻ video các thí nghiệm Cu + AgNO3, AgNO3 + HCl, CuSO4 + NaOH, AgNO3 + NaCl, Nhiệt phân KClO3
2. Học sinh: chuẩn bị bài ở nhà, xem trước các video, hoàn thành bảng mục II/trang 67.
III. Tổ chức dạy học
1. Ổn định lớp
2. Kiểm tra bài cũ: GV kiểm soát việc chuẩn bị bài về nhà của HS
Bạn đang xem tài liệu "Giáo án Hóa học Lớp 8 - Tiết 50+51, Bài 9: Muối", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
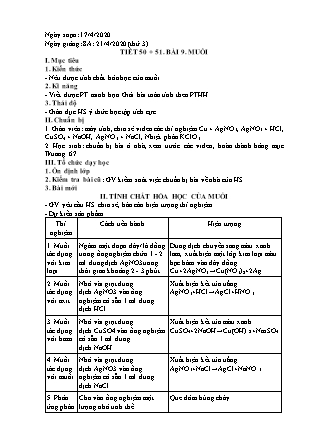
Ngày soạn: 17/4/2020 Ngày giảng: 8A: 21/4/2020 (thứ 3) TIẾT 50 + 51. BÀI 9. MUỐI I. Mục tiêu 1. Kiến thức - Nêu được tính chất hóa học của muối. 2. Kĩ năng - Viết được PT minh họa. Giải bài toán tính theo PTHH. 3. Thái độ - Giáo dục HS ý thức học tập tích cực II. Chuẩn bị 1. Giáo viên: máy tính, chia sẻ video các thí nghiệm Cu + AgNO3, AgNO3 + HCl, CuSO4 + NaOH, AgNO3 + NaCl, Nhiệt phân KClO3 2. Học sinh: chuẩn bị bài ở nhà, xem trước các video, hoàn thành bảng mục II/trang 67. III. Tổ chức dạy học 1. Ổn định lớp 2. Kiểm tra bài cũ: GV kiểm soát việc chuẩn bị bài về nhà của HS 3. Bài mới II. TÍNH CHẤT HÓA HỌC CỦA MUỐI - GV yêu cầu HS chia sẻ, báo cáo hiện tượng thí nghiệm - Dự kiến sản phẩm Thí nghiệm Cách tiến hành Hiện tượng 1. Muối tác dụng với kim loại Ngâm một đoạn dây/ lá đồng trong ống nghiệm chứa 1 - 2 ml dung dịch AgNO3trong thời gian khoảng 2 - 3 phút. Dung dịch chuyển sang màu xanh lam, xuất hiện một lớp kim loại màu bạc bám vào dây đồng. Cu+2AgNO3→Cu(NO3)2+2Ag 2. Muối tác dụng với axit Nhỏ vài giọt dung dịch AgNO3 vào ống nghiệm có sẵn 1 ml dung dịch HCl. Xuất hiện kết tủa trắng. AgNO3+HCl→AgCl+HNO3 3. Muối tác dụng với bazo Nhỏ vài giọt dung dịch CuSO4 vào ống nghiệm có sẵn 1 ml dung dịch NaOH. Xuất hiện kết tủa màu xanh. CuSO4+2NaOH→Cu(OH)2+Na2SO4 4. Muối tác dụng với muối Nhỏ vài giọt dung dịch AgNO3 vào ống nghiệm có sẵn 1 ml dung dịch NaCl Xuất hiện kết tủa trắng. AgNO3+NaCl→AgCl+NaNO3 5. Phản ứng phân hủy muối (nhiệt phân muối) Cho vào ống nghiệm một lượng nhỏ tinh thể muối KClO3 và một ít bột MnO2(làm xúc tác). Nung nóng ống nghiệm chứa KClO3 trên ngọn lửa đèn cồn khoảng 1 phút, thử khí sinh ra bằng cách đưa tàn đóm đỏ vào miệng ống nghiệm. Que đóm bùng cháy. 2KClO3to,MnO2, 2KCl+3O2 - GV dựa vào kết quả trên em hãy nêu t/c hóa học của muối? - HS nêu kết luận t/c hóa học của muối Kết luận: Tính chất hóa học của muối: + Dung dịch muối + Kim loại -> Muối (mới) + Kim loại (mới) Cu + Ag(NO3)2 → Cu(NO3)2 + 2Ag↓ Ag + CuSO4 → không p/ư * Chú ý: p/ư của muối + kim loại chỉ xảy ra khi kim loại tự do đứng trước kim loại của muối trong dãy HĐHH. K, Na, Ba, Ca, Mg, Al, Zn, Fe, Pb (H), Cu, Ag, Au + Muối + Axit -> Muối (mới) + Axit (mới) Na2CO3 + 2HCl → NaCl + H2O + CO2↑ BaCl2 + H2SO4 → BaSO4↓ + 2HCl NaCl + H2SO4 → không p/ư + Dung dịch muối + Dung dịch bazơ -> Muối (mới) + Bazơ (mới) MgCl2 + KOH → Mg(OH)2↓ + 2KCl Na2SO4 + KOH → ko p/ư + Dung dịch muối + Dung dịch muối -> Muối (mới) + Muối (mới) 2AlCl3 + 3Na2S → 6NaCl + Al2S3↓ + Một số muối bị nhiệt phân hủy -> các sản phẩm khác nhau tùy thuộc vào từng loại muối. MgCO3 to MgO + CO2↑ NaNO3 to NaNO2 + O2↑ 4. Luyện tập - củng cố (10p) - GV y/c HS hđ cá nhân 5 phút hoàn thành bài tập 1C/SHD trang 71 chỉ yêu cầu HS xét p/ư của Na2CO3 với các chất còn lại. - HS hoàn thành bài tập vào vở nháp, báo cáo, chia sẻ - GV nhận xét, bổ sung. - Dự kiến sản phẩm: (1) Na2CO3 + CaCO3 không p/ư vì có cùng gốc axit (2) Na2CO3 + K2SO4 không p/ư vì sản phẩm tạo thành không có chất kết tủa. (3) Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑ (4) Na2CO3 + Ba(OH)2 → BaCO3↓ + 2NaOH (5) Na2CO3 + Ba(NO3)2 → BaCO3↓ + 2NaNO3 (6) Na2CO3 + Mg(OH)2 → MgCO3↓ + 2NaOH - GV: Các phần còn lại HS về nhà tự làm. - GV y/c HS hoàn thành bài tập trắc nghiệm: Câu 1: Dung dịch muối Sắt(II)sunfat (FeSO4) có thể phản ứng với kim loại nào: A. Cu B. Al C. Ag D. Hg Câu 2: Các cặp muối và axit nào sau đây phản ứng được với nhau: A. Na2CO3 + H2SO4 B. HCl + Cu(NO3)2 C. HCl + MgSO4 D. HNO3 + NaCl Câu 3: Các cặp chất nào sau đây không phản ứng với nhau: 1. CuSO4 và HCl 2. H2SO4 và Ba(OH)2 3. KOH và NaCl 4. MgSO4 và BaCl2 A. (1; 2) B. (3; 4) C. (2; 4) D. (1; 3) Câu 4: Cho phương trình phản ứng: Na2CO3+ 2HCl → 2NaCl + X +H2O X là: A. SO2 B. CO2 C. H2 D. Cl2 Câu 5: Dùng muối nào sau đây có thể phân biệt được dung dịch NaOH và dung dịch Ca(OH)2: A. BaCl2 B. KCl C. K2CO3 D. KNO3 Câu 6: Nung hoàn toàn m gam muối CaCO3 thu được CaO và 11,2 lít khí CO2 (đo ở đktc). Giá trị của m là: A. 50 gam B. 150 gam C. 100 gam D. 50 gam - GV đánh giá kết quả tiếp thu bài của HS. 5. Hướng dẫn về nhà – 5p - Học bài cũ: HS làm bài tập 1,2C/t71 - Chuẩn bị bài mới: + Đọc thông tin mục 1/II trang 58 và hoàn thành khái niệm phản ứng trao đổi trang 59. Đọc thông tin mục 2 và nêu điều kiện sảy ra phản ứng trao đổi. + Đọc thông tin mục III/trang 59 tìm hiểu trạng thái tự nhiên, cách khai thác, ứng dụng của muối ăn. ---------------------------------------------- Ngày soạn: 17/4/2020 Ngày giảng: TIẾT 52. BÀI 9. MUỐI (t) I. Mục tiêu 1. Kiến thức - Nêu được trạng thái tự nhiên, tính chất vật lí, ứng dụng của muối ăn. - Củng cố kiến thức về tính chất hóa học của muối 2. Kĩ năng - Viết được PT minh họa. Giải bài toán tính theo PTHH. 3. Thái độ - Giáo dục HS ý thức học tập tích cực II. Chuẩn bị 1. Giáo viên: 2. Học sinh: chuẩn bị bài ở nhà tìm hiểu về trạng thái tự nhiên, tính chất vật lí, ứng dụng của muối ăn. III. Tổ chức dạy học 1. Ổn định lớp 2. Kiểm tra bài cũ: GV kiểm soát việc chuẩn bị bài về nhà của HS 3. Bài mới (30p) III. MỘT SỐ MUỐI QUAN TRỌNG - GV yêu cầu HS báo cáo phần chuẩn bị bài ở nhà. - HS báo cáo, chia sẻ nêu được t/c vật lí, trạng thái tự nhiên, ứng dụng của muối ăn. * KL: (SHD/trang ) - GV chốt kiến thức bài muối bằng sơ đồ tư duy 4. Luyện tập - củng cố (10p) - GV y/c HS hđ cá nhân 5 phút hoàn thành bài tập 2C/SHD trang 71 Bài 2. Viết PTHH của các phản ứng nhiệt phân muối sau: a) MgCO3,BaCO3 (biết sản phẩm phản ứng là oxit kim loại và khí CO2). b) NaNO3,KNO3 (biết sản phảm phản ứng là muối nitrit kim loại và khí oxi) c) Mg(NO3)2,Cu(NO3)2,Pb(NO3)2 (biết sản phẩm phản ứng là oxit kim loại, nito dioxit và oxi) - Dự kiến sản phẩm: MgCO3toMgO+CO2 BaCO3toBaO+CO2 2NaNO3to2NaNO2+O2 2KNO3to2KNO2+O2 2Mg(NO3)2to2MgO+4NO2+O2 2Cu(NO3)2to2CuO+4NO2+O2 2Pb(NO3)2to2PbO+4NO2+O2 - HS hoàn thành bài tập vào vở nháp, báo cáo, chia sẻ - GV nhận xét, bổ sung. - GV yêu cầu HS hoạt động cặp 5 phút hoàn thành bài tập 3C/SHD trang 71 Bài tập 3. Có các dung dịch riêng biệt, không nhãn sau: HCl,NaOH,NaCl,H2SO4,Ba(OH)2,K2SO4. Nếu trong phòng thí nghiệm chỉ có quỳ tím và các dụng cụ thí nghiệm thông thường như ống nghiệm, đèn cồn, ... thì có thể phân biệt được các dung dịch nào nói trên? Hãy trình bày cách phân biệt và viết PTHH của các phản ứng xảy ra. - HS báo cáo, chia sẻ - GV nhận xét, bổ sung. - Dự kiến sản phẩm: Thuốc thử HCl H2SO4 NaCl K2SO4 Ba(OH)2 NaOH Quỳ tím Quỳ tím hóa đỏ Quỳ tím hóa đỏ Quỳ tím không đổi màu Quỳ tím không đổi màu Quỳ tím hóa xanh Quỳ tím hóa xanh - Các dung dịch được chia làm 3 nhóm: Làm quỳ tím hóa đỏ (nhóm 1), làm quỳ tím hóa xanh (nhóm 2) và không làm đổi màu quỳ tím (nhóm 3). - Sau đó, cho lần lượt các dung dịch trong nhóm 1 tác dụng với các dung dịch nhóm 2 từng đôi một, quan sát hiện tượng như bảng sau để nhận biết các chất. HCl H2SO4 Ba(OH)2 Không có hiện tượng gì Ba(OH)2+HCl→BaCl2+H2O Xuất hiện kết tủa trắng Ba(OH)2+H2SO4→BaSO4+H2O NaOH Không có hiện tượng gì NaOH+HCl→NaCl+H2O Không có hiện tượng gì 2NaOH+H2SO4→Na2SO4+2H2O Sử dụng Ba(OH)2 đã nhận biết được ở trên cho tác dụng với nhóm thứ 3, phản ứng nào xuất hiện kết tủa trắng thì đó là K2SO4, còn lại là NaCl PTHH: Ba(OH)2+K2SO4→BaSO4+2KOH - GV nhận xét, đánh giá 5. Hướng dẫn về nhà – 5p - Học bài cũ: HS làm bài tập 3,4C/t71 - Chuẩn bị bài mới: + Ôn tập tính chất hóa học của muối, hoàn thành bài tập 3,4,5/SHD trang 71. + Chuẩn bị bài phi kim. ----------------------------------- Ngày soạn: 17/4/2020 Ngày giảng: TIẾT 53. BÀI 9. MUỐI (t) I. Mục tiêu 1. Kiến thức - Ôn tập tính chất hóa học của muối. 2. Kĩ năng - Viết được PT minh họa. Giải bài toán tính theo PTHH. 3. Thái độ - Giáo dục HS ý thức học tập tích cực II. Chuẩn bị 1. Giáo viên: máy tính, máy chiếu 2. Học sinh: ôn tập các kiến thức bài muối III. Tổ chức dạy học 1. Ổn định lớp 2. Kiểm tra bài cũ: GV kiểm soát việc chuẩn bị bài về nhà của HS 3. Bài mới (30p) HĐ 1. Kiến thức cần nhớ (10p) - GV yêu cầu HS hoạt động cá nhân 5 phút viết sơ đồ tư duy kiến thức bài muối. - HS báo cáo, chia sẻ. - GV nhận xét, đánh giá. - Dự kiến sản phẩm HĐ 2. Luyện tập - củng cố (30p) - GV yêu cầu HS hoạt động cá nhân tóm tắt bài tập 4/SHD trang 71 Bài tập 4. Nhúng một thanh Zn vào 100ml dung dịch CuSO4. Sau khi phản ứng kết thúc, lấy thanh Zn ra rửa sạch, làm khô rồi đem cân thì thấy khối lượng thanh Zn giảm đi 0,015 gam so với khối lượng thanh Zn ban đầu. Viết PTHH của phản ứng xảy ra và tính nồng độ mol của dung dịch CuSO4 đã dùng. - HS báo cáo, chia sẻ - Dự kiến sản phẩm: Tóm tắt: Cho: V CuSO4 = 100 ml = 0,1 lit mZn giảm = 0,015 gam Tính: CM CuSO4 = ? Bài giải - Gọi số mol Zn phản ứng là x (mol) Zn + CuSO4 → ZnSO4 + Cu (1) x x (mol) - Theo PT (1) ta có: 65.x – 64.x = 0,015 -> x = 0,015 (mol) nCuSO4 = 0,015 (mol) -> CM = 0,0150,1 = 0,15M - GV yêu cầu HS chữa bài tập 5C (8A,8B), (8C,8D GV hướng dẫn HS làm bài) Bài tập 5C/SHD trang 71. - Dự kiến sản phẩm: PTHH CaCO3 + 2HCl→CaCl2+CO2+H2O MgCO3 + 2HCl→MgCl2+CO2+H2O MgCl2 + 2NaOH→Mg(OH)2+2NaCl Mg(OH)2 to MgO + H2O Vậy chất rắn thu được sau phản ứng nhiệt phân là MgO. nCO2=2,29622,4=0,1025mol; nMgO=2,440=0,06mol Bảo toàn nguyên tố: nMgCO3=nMgO=0,06mol Vậy, phần trăm khối lượng của MgCO3 là: 0,06×8410×100%=50,5% Theo phương trình hóa học, ta có: nCO2=nCaCO3+nMgCO3 ⇒nCaCO3=nCO2−nMgCO3=0,1025−0,06=0,0425mol. Vậy phần trăm khối lượng của CaCO3 là: 0,0425×10010×100%=42,5% 5. Hướng dẫn về nhà – 5p - Học bài cũ: HS làm bài tập 3,4C/t71 - Chuẩn bị bài mới: + Ôn tập tính chất hóa học của muối, hoàn thành bài tập 3,4,5/SHD trang 71. + Chuẩn bị bài phi kim. -----------------------------------
Tài liệu đính kèm:
 giao_an_hoa_hoc_lop_8_tiet_5051_bai_9_muoi.docx
giao_an_hoa_hoc_lop_8_tiet_5051_bai_9_muoi.docx



