Kiểm tra đánh giá Cuối học kì I môn Hóa học Lớp 8 - Năm học 2020-2021 - Trường Trung học Cơ sở Xuy Xá (Có đáp án)
I. Trắc nghiệm khách quan(2đ).
Chọn và khoanh tròn lại đáp án đúng nhất.
Bài 1. Hạt nhân nguyên tử cấu tạo bởi:
A. Proton và electron B. Proton và nơtron
C. Nơtron và electron D. Proton, nơtron và electron.
Bài 2. Có 3 nguyên tử natri; 5 nguyên tử hiđro; 6 nguyên tử cacbon;
2 phân tử nước; 2 phân tử clo. Cách diễn đạt nào sau đây là đúng.
A. Na3; 5H2; 6C; 2H2O; 2Cl. B. 3Na; 5H2; 6C; 2H2O; 2Cl2
C. 3Na; 5H; 6C; 2H2O; 2Cl2. D. 3Na; 5H; 6C; 2H2O; 2Cl
Bạn đang xem tài liệu "Kiểm tra đánh giá Cuối học kì I môn Hóa học Lớp 8 - Năm học 2020-2021 - Trường Trung học Cơ sở Xuy Xá (Có đáp án)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
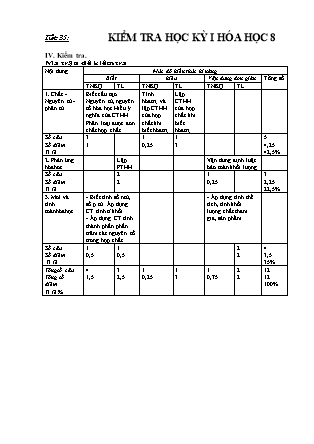
Tiết 35: KIỂM TRA HỌC KỲ I HÓA HỌC 8 IV. Kiểm tra. Ma trận đề kiểm tra Nội dung Mức độ kiến thức kĩ năng Biết hiểu Vận dụng đơn giản Tổng số TNKQ TL TNKQ TL TNKQ TL 1. Chất - Nguyên tử - phân tử. Biết cấu tạo Nguyên tử, nguyên tố hóa học Hiểu ý nghĩa của CTHH Phân loại được đơn chất hợp chất. Tính hóatrị và lập CTHH của hợp chất khi biết hóatrị. Lập CTHH của hợp chất khi biết hóatrị. Số câu Số điểm Tỉ lệ 3 1 1 0,25 1 3 5 4,25 42,5% 2. Phản ứng hóahoc. Lập PTHH Vận dung định luật bảo toàn khối lượng Số câu Số điểm Tỉ lệ 2 2 1 0,25 3 2,25 22,5% 3. Mol và tính toánhóahọc. - Biết tính số ntử, số p tử. Áp dụng CT tính tỉ khối. - Áp dụng CT tính thành phần phần trăm các nguyên tố trong hợp chất. - Áp dụng tính thể tích, tính khối lượng chất tham gia, sản phẩm. Số câu Số điểm Tỉ lệ 1 0,5 1 0,5 2 2 4 3,5 35% Tổngsố câu Tổng số điểm Tỉ lệ % 4 1,5 3 2,5 1 0,25 1 3 1 0,75 2 2 12 12 100% TRƯỜNG THCS XUY XÁ Họ và tên: . Lớp: KIỂM TRA ĐÁNH GIÁ CUỐI KÌ I MÔN: HÓA HỌC 8 Năm học : 2020 – 2021 Thứ ..ngày ..tháng .năm 2020 Điểm I. Trắc nghiệm khách quan(2đ). Chọn và khoanh tròn lại đáp án đúng nhất. Bài 1. Hạt nhân nguyên tử cấu tạo bởi: A. Proton và electron B. Proton và nơtron C. Nơtron và electron D. Proton, nơtron và electron. Bài 2. Có 3 nguyên tử natri; 5 nguyên tử hiđro; 6 nguyên tử cacbon; 2 phân tử nước; 2 phân tử clo. Cách diễn đạt nào sau đây là đúng. A. Na3; 5H2; 6C; 2H2O; 2Cl. B. 3Na; 5H2; 6C; 2H2O; 2Cl2 C. 3Na; 5H; 6C; 2H2O; 2Cl2. D. 3Na; 5H; 6C; 2H2O; 2Cl Bài 3. Nối cột A với cột B sao cho phù hợp. A. Loại chất Kết quả B. Chất cụ thể 1. Đơn chất 1............. 2............. a. HCl, NaCl, CaCO3, HNO3 b. O2, N2, H2, Cl2 c. CO, BaSO4, MgCO3, Na2SO4 2. Hợp chất d. Zn. Cu, Ca, Hg e. Ag, Ba, Fe, Pb Bài 4. CTHH của hợp chất nguyên tố R với nhóm SO4(II) là R2(SO4)3. CTHH của hợp chất nguyên tố R với clo là: A. RCl B. RCl2 C. RCl3 D. RCl4 Bài 5. Đốt cháy hoàn toàn 2,4 gam Magiê trong không khí thu được 4 gam magiê oxit. Khối lượng oxi tham gia phản ứng là: A. 2,4 B. 2,2 C. 1,8 D. 1,6 II. Tư luân(8đ). Bài 6.(2đ) Lâp CTHH của hợp chất gồm các nguyên tố sau: a. Kẽm (II) và nhóm PO4(III) b. Lưu huỳnh (VI) và oxi. ........................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................ Bài 7.(3đ) a. Tính thể tích ở (đktc) của hỗn hợp khí gồm 0,75 mol N2 và 0,25 mol H2. b. Tính thành phần phần trăm của Cu trong các hơp chất: CuO; CuSO4. c. Lập PTHH sau: 1. P + O2 → P2O5 2. Fe + HCl ® FeCl2 + H2 .................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................. Bài 8(3đ). Cho 13,5 gam nhôm tác dụng với HCl theo phản ứng sau: Al + HCl → AlCl3 + H2 a. Lập phương trình phản ứng? b. Xác định tỉ lệ các chất của phản ứng? c. Tính thể tích H2 sinh ra ở (đktc). .......................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ................................................................................................................................................................................................................................................................................................................................................................................................... Đáp án - Biểu điểm. I. Trắc nghiệm khách quan. (2 đ) Bài 1. B. Proton và nơtron 0,25đ Bài 2. B. 3Na; 5H; 6C; 2H2O; 2Cl2. 0,25đ Bài 3. Nối cột A với cột B sao cho phự hợp. 1đ ( mỗi ý đúng được 0,2đ) A. Loại chất Kết quả B. Hơp chất cụ thể 1. Đơn chất 1.b, d, e 2.a, c a. HCl, NaCl, CaCO3, HNO3 b. O2, N2, H2, Cl2 c. CO, BaSO4, MgCO3, Na2SO4 2. Hợp chất d. Zn. Cu, Ca, Hg e. Ag, Ba, Fe, Pb Bài 4. C. RCl3 0,25đ Bài 5. D. 1,6 0,25đ II. Tư luân(8đ). Bài 6. (2 điểm) a. ZnSO4 b. SO2 1đ 1đ Bài 7. (3 điểm) a. Vhh(đktc) = 22,4 (lit) b. Trong CuO: % Cu = 80% Trong CuSO4: % Cu = 40% c. PTHH sau: 1. 2P + 5O2 → 2P2O5 2. Fe + 2HCl ® FeCl2 + H2 1đ 1đ 0,5đ 0,5đ Bài 8. (3 điểm) a. 2Al + 6 HCl → 2AlCl3 + 3H2 b. Tỉ lệ: nguyên tử Al : phân tử HCl : phân tử AlCl3 : phân tử H2 = 2 : 6 : 2 : 3 c.V=16.8l 1đ 1đ 1đ
Tài liệu đính kèm:
 kiem_tra_danh_gia_cuoi_hoc_ki_i_mon_hoa_hoc_lop_8_truong_tru.doc
kiem_tra_danh_gia_cuoi_hoc_ki_i_mon_hoa_hoc_lop_8_truong_tru.doc



