Đề kiểm tra cuối học kì I môn Hóa học Lớp 8 - Trường Trung học Cơ sở Nghĩa Trung
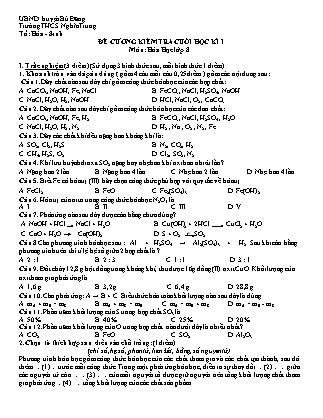
Câu 2. Hãy tính :
A. Số mol của 28 gam Fe , 10 gam CaCO3
B. Thể tích ở đktc của : 0,25 mol khí H2 và 0,3 mol khí O2
C. Khối lượng của : 0,1 mol H2SO4 và 0,5 mol Al(OH)3
D. Số mol có chứa trong 3.10¬23 phân tử H2O và 0,6.1023 phân tử CO2
Câu 3. Cho 4,8 g kim loại Magie tác dụng hết với dung dịch axit clohiđric HCl theo phương trình:
Mg + HCl MgCl2 + H2.
A. Lập phương trình hóa học của phản ứng trên.
B. Tính khối lượng Magie clorua MgCl2 tạo thành.
C. Tính thể tích khí H2 sinh (ở đktc).
Câu 4. Cho 13g kim loại kẽm vào dung dịch axit clohiđric (HCl) thu được muối kẽm clorua (ZnCl2) và khí hiđro.
A. Viết phương trình hóa học của phản ứng.
B. Tính khối lượng axit clohiđric (HCl) cần dùng cho phản ứng?
C. Tính thể tích khí hiđro thu được (ở đktc)?
Câu 5. Cho phương trình phản ứng sau : Fe + HCl → FeCl2 + H2. Nếu có 2,8 gam sắt tham gia phản ứng, em hãy:
A. Lập phương trình phản ứng trên
B. Tính thể tích H2 thu được ở đktc
C. Tính khối lượng HCl cần dùng
UBND huyện Bù Đăng Trường THCS Nghĩa Trung Tổ: Hóa - Sinh ĐỀ CƯƠNG KIỂM TRA CUỐI HỌC KÌ I Môn: Hóa Học lớp 8 I. Trắc nghiệm (3 điểm) (Sử dụng 3 hình thức sau, mỗi hình thức 1 điểm) 1. Khoanh tròn vào đáp án đúng ( gồm 4 câu mỗi câu 0,25 điểm ) gồm các nội dung sau: Câu 1. Dãy chất nào sau đây chỉ gồm công thức hóa học của các hợp chất: A. CaCO3, NaOH, Fe, NaCl. B. FeCO3, NaCl, H2SO4, NaOH. C. NaCl, H2O, H2, NaOH. D. HCl, NaCl, O2 , CaCO3. Câu 2. Dãy chất nào sau đây chỉ gồm công thức hóa học của các đơn chất: A. CaCO3, NaOH, Fe, H2. B. FeCO3, NaCl, H2SO4 , H2O. C. NaCl, H2O, H2 , N2. D. H2 , Na , O2 , N2 , Fe. Câu 3. Dãy các chất khí đều nặng hơn không khí là: A. SO2, Cl2, H2S. B. N2, CO2, H2. C. CH4, H2S, O2. D. Cl2, SO2, N2. Câu 4. Khí lưu huỳnh đioxit SO2 nặng hay nhẹ hơn khí oxi bao nhiêu lần? A. Nặng hơn 2 lần. B. Nặng hơn 4 lần. C. Nhẹ hơn 2 lần. D. Nhẹ hơn 4 lần. Câu 5. Biết Fe có hóa trị (III) hãy chọn công thức phù hợp với quy tắc về hóa trị A. FeCl2. B. FeO. C. Fe2(SO4)3. D. Fe(OH)2. Câu 6. Hóa trị của nitơ trong công thức hóa học N2O5 là A. I. B. II. C. III. D. V. Câu 7. Phản ứng nào sau đây được cân bằng chưa đúng? A. NaOH + HCl NaCl + H2O. B. Cu(OH)2 + 2HCl CuCl2 + H2O. C. CaO + H2O Ca(OH)2. D. S + O2 t0 SO2. Câu 8 Cho phương trình hóa học sau : Al + H2SO4 → Al2(SO4)3 + H2. Sau khi cân bằng phương trình trên thì tỉ lệ hệ số giữa 2 hợp chất là ? A. 2 : 1 B. 2 : 3 C. 1 : 1 D. 3 : 1. Câu 9. Đốt cháy 12,8 g bột đồng trong không khí, thu được 16g đồng (II) oxit CuO. Khối lượng của oxi tham gia phản ứng là A. 1,6 g. B. 3,2 g. C. 6,4 g. D. 28,8 g. Câu 10. Cho phản ứng: A → B + C. Biểu thức bảo toàn khối lượng nào sau đây là đúng A. mA + mB = mC B. mA + mC = mB C. mA = mB + mC D. mA = mB - mC Câu 11. Phần trăm khối lượng của S trong hợp chất SO3 là A. 50%. B. 40%. C. 25%. D. 20% Câu 12. Phần trăm khối lượng của O trong hợp chất nào dưới đây là nhiều nhất? A. CO2. B. FeO. C. SO2. D. Al2O3. 2.Chọn từ thích hợp sau điền vào chỗ trống: (1điểm) (chỉ số, hệ số, phân tử, liên kết, bằng, số nguyên tử) Phương trình hóa học gồm công thức hóa học của các chất tham gia và các chất tạo thành, sau đó thêm (1) trước mỗi công thức. Trong một phản ứng hóa học, diễn ra sự thay đổi (2) giữa các nguyên tử còn (3) của mỗi nguyên tố được giữ nguyên nên tổng khối lượng chất tham gia phản ứng (4).. tổng khối lượng của các chất sản phẩm. 3. Nối ý ở cột A với ý ở cột B cho phù hợp (1 điểm ) Cột A Cột B A1. Cồn để trong lọ không kín bị bay hơi. A2. Đốt than trong không khí. A3. AgNO3 có phân tử khối bằng A4. Fe(OH)3 có phân tử khối bằng A5. Thức ăn để lâu ngày bị ôi thiu. A6. Dây sắt cắt nhỏ tán thành đinh sắt. A7. 4Al + 3O2 t0 ? A8. ? + 3Cl2 2AlCl3 B1. 2Al2O3. B2. 2Al. B3. Hiện tượng hóa học. B4. 107 đvC B5. 170 đvC B6. Hiện tượng vật lí II.TỰ LUẬN ( 7 điểm ) Lấy 3 câu trong các dạng bài tập sau Câu 1. Hoàn thành các phương trình hóa học theo sơ đồ sau: A. Al + H2O + NaOH NaAlO2 + H2 B. Mg + HNO3 Mg(NO3)2 + H2 C. C2H6O + O2 t0 CO2 + H2O D. P + O2 t0 P2O5 E. Al(OH )3 t0 Al2O3 + H2O F. Fe3O4 + C t0 Fe + CO2 Câu 2. Hãy tính : Số mol của 28 gam Fe , 10 gam CaCO3 Thể tích ở đktc của : 0,25 mol khí H2 và 0,3 mol khí O2 Khối lượng của : 0,1 mol H2SO4 và 0,5 mol Al(OH)3 Số mol có chứa trong 3.10 23 phân tử H2O và 0,6.1023 phân tử CO2 Câu 3. Cho 4,8 g kim loại Magie tác dụng hết với dung dịch axit clohiđric HCl theo phương trình: Mg + HCl MgCl2 + H2. A. Lập phương trình hóa học của phản ứng trên. B. Tính khối lượng Magie clorua MgCl2 tạo thành. C. Tính thể tích khí H2 sinh (ở đktc). Câu 4. Cho 13g kim loại kẽm vào dung dịch axit clohiđric (HCl) thu được muối kẽm clorua (ZnCl2) và khí hiđro. Viết phương trình hóa học của phản ứng. Tính khối lượng axit clohiđric (HCl) cần dùng cho phản ứng? Tính thể tích khí hiđro thu được (ở đktc)? Câu 5. Cho phương trình phản ứng sau : Fe + HCl → FeCl2 + H2. Nếu có 2,8 gam sắt tham gia phản ứng, em hãy: Lập phương trình phản ứng trên Tính thể tích H2 thu được ở đktc Tính khối lượng HCl cần dùng
Tài liệu đính kèm:
 de_kiem_tra_cuoi_hoc_ki_i_mon_hoa_hoc_lop_8_truong_trung_hoc.docx
de_kiem_tra_cuoi_hoc_ki_i_mon_hoa_hoc_lop_8_truong_trung_hoc.docx



