Bài giảng Hóa học Lớp 8 - Bài 34: Bài luyện tập 6
Bài tập 3:
Lập phương trình hóa học của các phản ứng sau :
Cacbon đioxit + nước ---> axit cacbonic (H2CO3) (1)
Lưu huỳnh đioxit + nước---> axit sunfurơ (H2SO3) (2)
Kẽm + axit clohiđric ---> kẽm clorua + H2 (3)
Điphotpho pentaoxit + nước --->axit photphoric (H3PO4) (4)
Chì (II) oxit + hiđro ---> chì (Pb) + H2O (5)
b/ Mỗi phản ứng hóa học trên đây thuộc loại phản ứng nào?
Bạn đang xem tài liệu "Bài giảng Hóa học Lớp 8 - Bài 34: Bài luyện tập 6", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
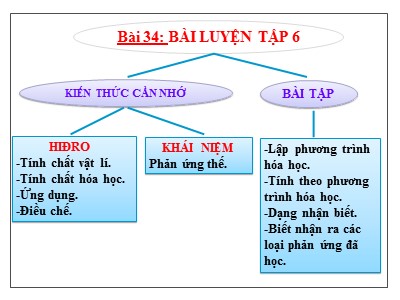
HIĐRO -Tính chất vật lí. -Tính chất hóa học. -Ứng dụng. -Điều chế. KHÁI NIỆM Phản ứng thế. -Lập phương trình hóa học. -Tính theo phương trình hóa học. -Dạng nhận biết. -Biết nhận ra các loại phản ứng đã học. Bài 34: BÀI LUYỆN TẬP 6 KIẾN THỨC CẦN NHỚ BÀI TẬP KIẾN THỨC CẦN NHỚ n guyên tử Bài tập 1: Viết phương trình hóa học biểu diễn phản ứng của H 2 với các chất: O 2 , Fe 2 O 3 , Fe 3 O 4 , PbO. Ghi rõ điều kiện phản ứng. HOẠT ĐỘNG VẬN DỤNG VÀ LUYỆN TẬP 2H 2 + O 2 2H 2 O t 0 3H 2 + Fe 2 O 3 2Fe + 3H 2 O t 0 4H 2 + Fe 3 O 4 3Fe + 4H 2 O t 0 H 2 + PbO Pb + H 2 O t 0 1 2 3 Không làm thay đổi ngọn lửa que đóm Que đóm bùng cháy Có khí cháy với ngọn lửa xanh mờ. Không khí Khí Oxi Khí Hiđro Bài tập 2: Có 3 lọ mất nhãn đựng riêng biệt các khí : oxi, hiđro, không khí. Bằng thí nghiệm hoá học nào có thể nhận ra các chất khí trong mỗi lọ ? Bài tập 3: a/ Lập phương trình hóa học của các phản ứng sau : Cacbon đioxit + nước ---> axit cacbonic (H 2 CO 3 ) (1) Lưu huỳnh đioxit + nước---> axit sunfurơ (H 2 SO 3 ) (2) Kẽm + axit clohiđric - --> kẽm clorua + H 2 (3) Điphotpho pentaoxit + nước --->axit photphoric (H 3 PO 4 ) (4) Chì (II) oxit + hiđro ---> chì (Pb) + H 2 O (5) b/ Mỗi phản ứng hóa học trên đây thuộc loại phản ứng nào? t 0 ĐÁP ÁN 1/ CO 2 + H 2 O H 2 CO 3 (P/ứng hóa hợp) 2/ SO 2 + H 2 O H 2 SO 3 (P/ứng hóa hợp) 3/ Zn + HCl ZnCl 2 + H 2 (P/ứng thế) 4/ P 2 O 5 + 3H 2 O 2H 3 PO 4 (P/ứng hóa hợp) 5/ PbO + H 2 Pb + H 2 O (P/ứng khử) t 0 BT4: Có thể dùng: dung dịch axit sunfuric loãng ; kim loại nhôm và dụng cụ thí nghiệm như hình bên để Đồng ý Xóa A) Điều chế và thu khí Oxi B) Điều chế và thu không khí C) Điều chế và thu khí Hidro D) Điều chế khí Hidro nhưng không thể thu khí Hidro Bài tập 5: Lập phương trình hóa học của các phản ứng sau và cho biết chúng thuộc loại phản ứng hóa học nào? 1 / Kẽm + axit Sunfuric (H 2 SO 4 ) Kẽm sunfat (ZnSO 4 )+ hiđro Zn + H 2 SO 4 ZnSO 4 + H 2 ↑ (PƯ thế) 2 / Thủy ngân (II) oxit t 0 Thủy ngân + oxi 2HgO t o 2Hg + O 2 ↑ (PƯ phân hủy) Người ta dùng V(lít) khí H 2 khử hoàn toàn hỗn hợp hai Oxit kim loại gồm: CuO và Fe 2 O 3 ở nhiệt độ thích hợp. Sau phản ứng thu được 12g hỗn hợp gồm 2 kim loại trong đó có 6,4g Cu. a/ Viết các PTHH xảy ra . b/ Hãy tính V(lít ) khí H 2 cần dùng để khử hỗn hợp 2 oxit đó . (Các thể tích khí đo ở đktc) a/ PTHH H 2 + CuO Cu + H 2 O (1) 3H 2 + Fe 2 O 3 2Fe + 3H 2 O (2) t 0 t 0 Gợi ý bài làm : Bài tập 6 : b/ Tính khối lượng của Fe => Số mol Fe, Cu. Từ 2 phương trình tính số mol của H 2 => tính V của H 2 LUẬT CHƠI Gồm 4 câu hỏi Mỗi câu hỏi đưa ra có mức độ khó dần. Các thí sinh chọn đáp án trong vòng 15 giây . Nếu trả lời sai thì không được trả lời câu tiếp theo. Trả lời đúng câu nào thí sinh sẽ có điểm tương ứng trên câu đó. - Người thắng cuộc là người có tổng số điểm cao nhất. RUNG CHUÔNG VÀNG Câu 1 : (5 điểm) Trong các dịp lễ hội, em thường thấy thả bóng bay. Những quả bóng đó có thể được bơm bằng những khí gì? A. oxi O 2 B. hiđro H 2 C. cacbonic CO 2 D. không khí 15 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1 Hết giờ Câu 2 : (10 điểm) T hí nghiệm: Cho kim loại kẽm vào dung dịch axit clohiđric. Theo em PTHH xảy ra là? A. Zn + 2HCl ZnCl + H 2 B. Zn + HCl ZnCl + H 2 C. Zn + 2HCl ZnCl 2 + H 2 D. Zn + 2HCl ZnCl 2 + 2H 2 15 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1 Hết giờ Câu 3 : ( 15 điểm) Thể tích khí hiđro (đktc) cần dùng để hóa hợp với khí oxi tạo ra 0,1 mol nước là 6,72 lít 22,4 lít 4,48 lít D. 2,24 lít 15 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1 Hết giờ Câu 4 :( 20 điểm) Cho 6,5 g kẽm vào dung dịch chứa 0,25 mol axit clohiđric. Chất còn dư sau phản ứng là A. Zn B. HCl C. Hai chất vừa hết D. Không xác định được (Cho Zn = 65) 15 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1 Hết giờ HOẠT ĐỘNG TÌM TÒI MỞ RỘNG: BT: Viết các phương trình hóa học biểu diễn các biến hóa sau và cho biết mỗi phản ứng đó thuộc loại phản ứng hóa học nào? a) Na Na 2 O NaOH b) P P 2 O 5 H 3 PO 4 c) Fe 2 O 3 Fe FeCl 2 - Tìm hiểu một số ứng dụng của các phản ứng thế, phân hủy, hóa hợp trong đời sống. (1) (1) (1) (2) (2) (2) BTVN: 2 , 3, 6 * /119 SGK; 33.4 , 33.7/47 SBT . Hướng dẫn về nhà : 6 * /119 SGK: Dựa vào tỉ lệ số mol giữa các chất để so sánh thể tích H 2 tham gia và khối lượng các kim loại phản ứng. a. Zn, Al, Fe tác dụng với dd axit sunfuric (H 2 SO 4 ) loãng Zn + H 2 SO 4 ZnSO 4 + H 2 (1) 2Al + 3H 2 SO 4 Al 2 (SO 4 ) 3 + 3H 2 (2) Fe + H 2 SO 4 FeSO 4 + H 2 (3) c.Tính số mol kim loại theo số mol H 2 sau đó tính khối lượng từng kim loại rồi so sánh. * Chuẩn bị bài thực hành 5: Điều chế, thu khí và thử tính chất của khí H 2 . Bài số 6 SGK trang 119 CHÀO TẠM BIỆT! Kính chúc các em học tập tốt!
Tài liệu đính kèm:
 bai_giang_hoa_hoc_lop_8_bai_34_bai_luyen_tap_6.pptx
bai_giang_hoa_hoc_lop_8_bai_34_bai_luyen_tap_6.pptx



