Bài giảng Hóa học Lớp 8 - Chương 5: Hiđro-Nước - Chủ đề: Hiđro
I. TÍNH CHẤT VẬT LÍ:
- Khí H2 là chất khí, không màu, không mùi, không vị.
- Nhẹ hơn không khí.(Nhẹ nhất trong các khí)
- Tan rất ít trong nước.
+ Hãy so sánh tính chất vật lí của H2 và O2?
Giống nhau: Đều là chất khí, không màu, không mùi, không vị, ít tan trong nước.
Bạn đang xem 20 trang mẫu của tài liệu "Bài giảng Hóa học Lớp 8 - Chương 5: Hiđro-Nước - Chủ đề: Hiđro", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
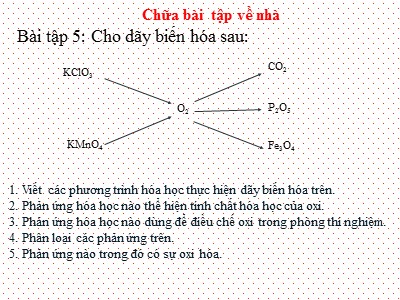
Chữa bài tập về nhà Bài tập 5: Cho dãy biến hóa sau: KMnO 4 O 2 CO 2 P 2 O 5 Fe 3 O 4 KClO 3 1. Viết các phương trình hóa học thực hiện dãy biến hóa trên. 2. Phản ứng hóa học nào thể hiện tính chất hóa học của oxi. 3. Phản ứng hóa học nào dùng để điều chế oxi trong phòng thí nghiệm. 4. Phân loại các phản ứng trên. 5. Phản ứng nào trong đó có sự oxi hóa. 1. Viết các phương trình hóa học: 2 KCl + 3O 2 2. 2KMnO 4 K 2 MnO 4 + O 2 + MnO 2 3. O 2 + C CO 2 4. 5O 2 + 4P 2P 2 O 5 5. 2O 2 + 3Fe Fe 3 O 4 1. 2KClO 3 t 0 t 0 t 0 t 0 t 0 t 0 t 0 t 0 t 0 t 0 2. Phương trình hóa học thể hiện tính chất hóa học của oxi : 2 KCl + 3O 2 2. 2KMnO 4 K 2 MnO 4 + O 2 + MnO 2 3. O 2 + C CO 2 4. 5O 2 + 4P 2P 2 O 5 5. 2O 2 + 3Fe Fe 3 O 4 1. 2KClO 3 2 KCl + 3O 2 2. 2KMnO 4 K 2 MnO 4 + O 2 + MnO 2 3. O 2 + C CO 2 4. 5O 2 + 4P 2P 2 O 5 5. 2O 2 + 3Fe Fe 3 O 4 1. 2KClO 3 3. Phương trình hóa học điều chế oxi trong phòng thí nghiệm : t 0 t 0 t 0 t 0 t 0 t 0 t 0 t 0 t 0 t 0 4. Phân loại các phản ứng : (PỨ hóa hợp ) (PỨ hóa hợp ) ( PỨ hóa hợp ) ( PỨ phân hủy ) ( PỨ phân hủy ) 2 KCl + 3O 2 2. 2KMnO 4 K 2 MnO 4 + O 2 + MnO 2 3. O 2 + C CO 2 4. 5O 2 + 4P 2P 2 O 5 5. 2O 2 + 3Fe Fe 3 O 4 1. 2KClO 3 t 0 t 0 t 0 t 0 t 0 5. Phương trình hóa học trong đó xảy ra sự oxi hóa : 2 KCl + 3O 2 2. 2KMnO 4 K 2 MnO 4 + O 2 + MnO 2 3. O 2 + C CO 2 4. 5O 2 + 4P 2P 2 O 5 5. 2O 2 + 3Fe Fe 3 O 4 1. 2KClO 3 CHƯƠNG 5: HIĐRO – NƯỚC CHỦ ĐỀ HIĐRO Kí hiệu: CTHH: NTK: PTK: H H 2 1 2 I. TÍNH CHẤT VẬT LÍ: Hãy quan sát bình đựng khí hiđro và nhận xét :trạng thái, màu sắc .? Khí H 2 Quan sát quả bóng bay chứa khí hi đ ro. Cho biết hiện tượng xảy ra? H 2 O 2 Quan sát quả bóng bay chứa khí hidro và quả bóng có chứa khí O 2 . Cho biết hiện tượng xảy ra? Trả lời câu hỏi: 1 lít nước ở 15 o C hòa tan được 31 ml khí oxi. 1 lít nước ở 15 0 C hòa tan được 20 ml khí hiđro . Vậy khí hiđro là chất tan nhiều hay tan ít trong nước? I. TÍNH CHẤT VẬT LÍ: - Khí H 2 là chất khí, không màu, không mùi, không vị. - Nhẹ hơn không khí.(Nhẹ nhất trong các khí) - Tan rất ít trong nước. + Hãy so sánh tính chất vật lí của H 2 và O 2 ? Oxi Nặng hơn không khí Hóa lỏng ở - 183 o C Hiđro Nhẹ hơn không khí (nhẹ nhất.) Hóa lỏng ở - 260 0 C * Giống nhau : Đều là chất khí, không màu, không mùi, không vị, ít tan trong nước. * Khác nhau a) Đẩy nước b) Đẩy không khí a) Đẩy nước b) Đẩy không khí C¸ch thu khÝ oxi Cách thu khí hiđro II. TÍNH CHẤT HÓA HỌC. 1. Tác dụng với oxi. 1-Đốt hiđro trong không khí TIẾN HÀNH THÍ NGHIỆM H 2 HCl Zn O 2 Bước 1: Đốt hiđro trong không khí Bước 2: Dùng cốc thủy tinh úp trên đầu ngọn lửa của khí hiđro đang cháy 2- Đốt hiđro trong oxi Hiđro cháy trong oxi tạo ra hơi nước, đồng thời phản ứng tỏa nhiều nhiệt. Do phản ứng tỏa nhiều nhiệt nên người ta dùng hiđro làm nhiên liệu cho đèn xì oxi – hiđro để hàn cắt kim loại. Ta tiến hành thí nghiệm: H 2 O 2 Đốt cháy hỗn hợp khí hiđro và oxi 2 V H 2 + 1 V O 2 1.Tại sao hỗn hợp khí H 2 và O 2 khi cháy lại gây ra tiếng nổ? 2. Làm thế nào để biết dòng khí H 2 là tinh khiết để khi đốt cháy dòng khí mà không gây ra tiếng nổ mạnh ? Dùng ống nghiệm nhỏ thu khí H2 (PP đẩy khí) và đốt trên ngọn lửa đèn cồn nếu có tiếng nổ nhẹ “PÚP” hoặc không còn tiếng nổ là khí H 2 tinh khiết. Hỗn hợp khí H 2 và O 2 khi cháy gây ra tiếng nổ vì:-Hỗn hợp khí này cháy rất nhanh và toả nhiều nhiệt. Nhiệt này làm thể tích hơi nước sau phản ứng tăng lên đột ngột nhiều lần làm chấn động mạnh không khí , gây ra tiếng nổ . Bài tập 2: Hỗn hợp khí hiđro và khí oxi khi đốt là hỗn hợp nổ. Hỗn hợp sẽ gây nổ mạnh nhất khi trộn tỉ lệ về thể tích hiđro với oxi là: A. 1 : 1 C. 1 : 2 B. 2 : 1 D. 2 : 2 Bài tập 1: Khi thu khí hiđro vào bình bằng phương pháp đẩy không khí thì phải để: B. Ngửa bình. C. Úp bình. A. Nghiêng bình. CHỦ ĐỀ HIĐRO II. TÍNH CHẤT HÓA HỌC 1. Tác dụng với oxi (H 2 cháy với ngọn lửa màu xanh nhạt) 2. Tác dụng với đồng(II) oxit hay oxit bazơ PTHH: 2H 2 + O 2 2H 2 O t o Quan sát hiện tượng xảy ra khi dẫn khí hi đro qua đồng (II) oxit đun nóng. H 2 CuO H 2 O Đèn cồn O H Cu Cơ chế phản ứng giữa CuO và H 2 : H O H Cu H t o H 2 O + H 2 O 2 H 2 O t o H 2 Cu O + + H 2 H 2 O Cu 2 2 II- TÝnh chÊt hãa häc T¸c dông víi oxi: H 2 + O 2 2H 2 O 2. T¸c dông víi ®ång oxit: H 2 + CuO H 2 O + Cu t o t o III. ỨNG DỤNG CỦA HIĐRO: Phương tiện giao thông gây ô nhiễm môi trường Ở Mỹ ô tô được chế tạo sử dụng nguyên liệu khí hiđro ? Đọc mục I.1a thí nghiệm sgk/114 nêu hóa chất dùng để điều chế khí Hiđro trong PTN IV. ĐIỀU CHẾ KHÍ HIĐRO 1. Hóa chất. Dung dịch HCl, H 2 SO 4 (loãng), Fe, Zn, Al . Diêm Nút cao su có gắn ống dẫn khí Kẹp gỗ Ống nghiệm Chậu thủy tinh Ống hút Kẽm (Zn) dd HCl Tấm kính Đèn cồn Các dụng cụ, hóa chất cần thiết dùng cho thí nghiệm? Tiến hành thí nghiệm Nước Khí hidro Nước Zn +HCl Thí nghiệm: Điều chế khí hiđro trong phòng thí nghiệm Các bước tiến hành thí nghiệm Hiện tượng xảy ra Bước 1 : Nhỏ 2-3 ml dung dịch axit HCl vào ống nghiệm chứa 2 – 3 hạt kẽm. Bước 2 : Đậy ống nghiệm bằng nút cao su có ống dẫn khí xuyên qua, sau 1 phút đưa tàn đóm đỏ vào đầu ống dẫn khí. Bước 3 : Đưa que đóm đang cháy vào đầu ống dẫn khí. Kim loại kẽm tan dần, có bọt khí xuất hiện trên bề mặt hạt kẽm rồi thoát ra khỏi dung dịch. Tàn đóm đỏ không bùng cháy Khí thoát ra cháy trong không khí với ngon lửa màu xanh nhạt Bước 4: Thu khí hiđro thoát ra a. Nguyên liệu: Dung dịch HCl, H 2 SO 4 (loãng), Fe, Zn, Al . b. Phương trình hóa học: Zn + 2HCl → ZnCl 2 + H 2 Fe + 2HCl → FeCl 2 + H 2 c. Phương pháp thu khí Hiđro Bằng cách đẩy không khí (úp ngược bình thu) Bằng cách đẩy nước. Có mấy cách thu khí Hiđro nhỉ? IV. ĐIỀU CHẾ KHÍ HIĐRO Zn + 2HCl ZnCl 2 + H 2 Zn 2HCl Cl Zn 2 H + 2 Zn + Khái niệm : Ph¶n øng thÕ lµ ph¶n øng hãa häc gi÷a ®¬n chÊt vµ hîp chÊt, trong ®ã nguyªn tö cña ®¬n chÊt thay thÕ nguyªn tö cña mét nguyªn tè trong hîp chÊt. V. PHẢN ỨNG THẾ. Bài tập vận dụng : Cho các phương trình hóa học sau: (1) 2Al + 3CuCl 2 2AlCl 3 + 3Cu (2) Na 2 O + H 2 O 2 NaOH 2Al + 3H 2 SO 4 Al 2 (SO 4 ) 3 + 3H 2 (4) Na 2 SO 4 + BaCl 2 2NaCl +BaSO 4 Những PTHH mô tả phản ứng thế là: A. 1; 2 B. 2; 3 C. 1; 3 D. 2,4 Hãy chọn đáp án đúng . B ài 1 /sgk trang 109. Viết phương trình hóa học cho các phản ứng giữa hidro và các oxit sau: a. Sắt (III) oxit b. Thủy ngân (II) oxit c. Chì (II) oxit Giải: Các phương trình hóa học: Fe 2 O 3 + 3H 2 2Fe + 3H 2 O HgO + H 2 Hg + H 2 O PbO + H 2 Pb + H 2 O t 0 t 0 t 0 I V . LUYỆN TẬP Bài tập 4 / sgk trang 109. Khử 48 gam đồng (II) oxit bằng khí hi đ ro. H ãy : a) Tính số gam kim loại đồng thu được. b) T ính thể tích khí hiđro(đktc) cần dùng. Giải: a) n CuO = 48/80 = 0,6 (mol) PTHH: CuO + H 2 Cu + H 2 O Theo PTHH thì n Cu = n CuO = 0,6 (mol) Vậy m Cu = n Cu .M cu = 0,6.64 = 38,4 (gam) b) Theo PTHH thì n H2 = n CuO = 0,6 (mol) Vậy V H2 = n H2 .22,4 = 0,6.22,4 = 13,4 4(lít) Bài tập 1: Đốt cháy hoàn toàn 6,72 lít khí Hiđro trong không khí. a) Viết PTHH của phản ứng. b) Tính khối lượng và thể tích oxi cần dùng ? ( Biết thể tích các khí được đo ở đktc ) Bài tập 2: T ính s ố gam n ước thu được khi cho 8,4 lít kh í hi đr o t ác d ụng v ới 2,8 lít kh í oxi ( Biết thể tích các khí được đo ở đktc ) Bài tập 3. Dẫn 8,96 lit khí H2 (đktc) qua 46,4 g FeO. Tính khối lượng chất rắn thu được sau phản ứng? SƠ ĐỒ VỀ KHÍ HIĐRO
Tài liệu đính kèm:
 bai_giang_hoa_hoc_lop_8_chuong_5_hidro_nuoc_chu_de_hidro.ppt
bai_giang_hoa_hoc_lop_8_chuong_5_hidro_nuoc_chu_de_hidro.ppt



