Đề cương lý thuyết ôn thi học sinh giỏi Hóa học Lớp 8 - Trường THCS Cộng Hòa
Tại sao hỗn hợp khí hiđro và khí oxi khi cháy lại gây ra
tiếng nổ?
b) Nếu đốt cháy dòng khí hiđro ngay ở đầu ống dẫn khí, dù
ở trong lọ khí oxi hay không khí, sẽ không gây ra tiếng nổ
mạnh. Vì sao?
c) Làm thế nào để biết khí hiđro sinh ra làm tinh khiết?
Hƣớng dẫn
a) Hỗn hợp khí hiđro và oxi cháy lại gây ra tiếng nổ vì: Hỗn hợp khí này cháy rất nhanh và tỏa nhiều
nhiệt. Nhiệt này làm thể tích hơi nước sau phản ứng tăng lên đột ngột nhiều làn, do đó làm chấn động
mạng không khí, gây ra tiếng nổ.
b) Nếu đốt cháy dòng khí hiđro ngay ở đầu ống dẫn khí, dù ở trong lọ khí oxi hay không khí sẽ không gây
ra tiếng nổ mạng vì tỉ lệ thể tích của hiđro và oxi khác 2:1 . khi tỉ lệ thể tích của hiđro và oxi = 2:1 thì hỗn
hợp sẽ nổ mạnh nhất.
c) Để biết dòng khí hiđro sinh ra là tinh khiết thì: thu hiđro vào ống nghiệm nhỏ , rồi đốt ở miệng ống
nghiệm. Nếu hiđro là tinh khiết thì chỉ nghe tiếng nổ nhỏ, nếu hiđro có lẫn oxi (Hoặc không khí) thì có
tiếng nổ mạnh.Bài 2. Giải thích tại sao?
a) Khí nito và khí cacbonic đều không duy trì sự cháy, nhưng
chỉ dùng khí cacbonic để chữa cháy mà không dùng khí nito
b) Quả bóng bơm khí cacbonic thì không bay được, quả bóng
bơm khí hidro thì bay lên cao được?
c) Khi muốn thoát khỏi đám cháy thì người ta cần phải cúi
thấp để di chuyển?
d) Người thợ xuống các giếng sâu, hầm mỏ thường mang theo
bình oxi để thở?
TRƢỜNG THCS CỘNG HÒA
LẦN 3 – LÝ THUYẾT
ĐỀ CƢƠNG LÝ THUYẾT HSG
MÔN: HÓA HỌC 8
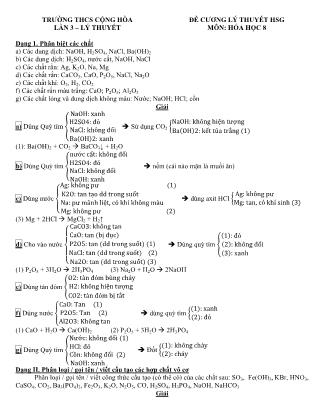
Dạng 1. Phân biệt các chất
a) Các dung dịch: NaOH, H2SO4, NaCl, Ba(OH)2
b) Các dung dịch: H2SO4, nước cất, NaOH, NaCl
c) Các chất rắn: Ag, K2O, Na, Mg
d) Các chất rắn: CaCO3, CaO, P2O5, NaCl, Na2O
e) Các chất khí: O2, H2, CO2
f) Các chất rắn màu trắng: CaO; P2O5; Al2O3
g) Các chất lỏng và dung dịch không màu: Nước; NaOH; HCl; cồn
Giải
a) Dùng Quỳ tím {
( )
Sử dụng CO2 {
( ) ( )
(1): Ba(OH)2 + CO2 BaCO3↓ + H2O
b) Dùng Quỳ tím {
nếm (cái nào mặn là muối ăn)
c) Dùng nước {
( )
( )
dùng axit HCl {
( )
(3) Mg + 2HCl MgCl2 + H2↑
d) Cho vào nước
{
( )
( ) ( )
( ) ( )
( ) ( )
Dùng quỳ tím {
( )
( )
( )
(1) P2O5 + 3H2O 2H3PO4 (3) Na2O + H2O 2NaOH
e) Dùng tàn đóm {
f) Dùng nước {
( )
( )
dùng quỳ tìm {
( )
( )
(1) CaO + H2O Ca(OH)2 (2) P2O5 + 3H2O 2H3PO4
g) Dùng Quỳ tím {
( )
( )
Đốt {
( )
( )
Dạng II. Phân loại / gọi tên / viết cấu tạo các hợp chất vô cơ
Phân loại / gọi tên / viết công thức cấu tạo (có thể có) của các chất sau: SO3, Fe(OH)3, KBr, HNO3,
CaSO4, CO2, Ba3(PO4)2, Fe2O3, K2O, N2O5, CO, H2SO4, H3PO4, NaOH, NaHCO3
Giải
CTHH Gọi tên Phân loại CTCT (nếu có)
SO3 Lưu huỳnh trioxit Oxit axit
Fe(OH)3 Sắt (III) hidroxit Bazo không tan
KBr Kali brommua Muối trung tính K-Br
HNO3 Axit nitric Axit có nhiều oxi
CaSO4 Caxi sunfat Muối trung tính
CO2 Cacbon đioxit Oxit axit O=C=O
Ba3(PO4)2 Bari photphat Muối trung tính
Fe2O3 Sắt (III) oxit Oxit bazo
K2O Kali oxi Oxit bazo K-O-K
N2O5 Đinito pentaoxit Oxit axit
H2SO3 Axit sunfuro Axit có ít oxi
H2SO4 Axit sunfuric Axit có nhiều oxi
H3PO4 Axit photphoric Axit có nhiều oxi
NaOH Natri hidroxit Bazo tan Na-O-H
NaHCO3 Natri hidrocacbonat Muối axit
Dạng III. Giải thích các hiện tƣợng
Bài 1.
a) Tại sao hỗn hợp khí hiđro và khí oxi khi cháy lại gây ra
tiếng nổ?
b) Nếu đốt cháy dòng khí hiđro ngay ở đầu ống dẫn khí, dù
ở trong lọ khí oxi hay không khí, sẽ không gây ra tiếng nổ
mạnh. Vì sao?
c) Làm thế nào để biết khí hiđro sinh ra làm tinh khiết?
Hƣớng dẫn
a) Hỗn hợp khí hiđro và oxi cháy lại gây ra tiếng nổ vì: Hỗn hợp khí này cháy rất nhanh và tỏa nhiều
nhiệt. Nhiệt này làm thể tích hơi nước sau phản ứng tăng lên đột ngột nhiều làn, do đó làm chấn động
mạng không khí, gây ra tiếng nổ.
b) Nếu đốt cháy dòng khí hiđro ngay ở đầu ống dẫn khí, dù ở trong lọ khí oxi hay không khí sẽ không gây
ra tiếng nổ mạng vì tỉ lệ thể tích của hiđro và oxi khác 2:1 . khi tỉ lệ thể tích của hiđro và oxi = 2:1 thì hỗn
hợp sẽ nổ mạnh nhất.
c) Để biết dòng khí hiđro sinh ra là tinh khiết thì: thu hiđro vào ống nghiệm nhỏ , rồi đốt ở miệng ống
nghiệm. Nếu hiđro là tinh khiết thì chỉ nghe tiếng nổ nhỏ, nếu hiđro có lẫn oxi (Hoặc không khí) thì có
tiếng nổ mạnh.
Bài 2. Giải thích tại sao?
a) Khí nito và khí cacbonic đều không duy trì sự cháy, nhưng
chỉ dùng khí cacbonic để chữa cháy mà không dùng khí nito
b) Quả bóng bơm khí cacbonic thì không bay được, quả bóng
bơm khí hidro thì bay lên cao được?
c) Khi muốn thoát khỏi đám cháy thì người ta cần phải cúi
thấp để di chuyển?
d) Người thợ xuống các giếng sâu, hầm mỏ thường mang theo
bình oxi để thở?
e) Khi mở nắp chai nước ngọt ta thấy hiện tượng sủi bọt khí?
a b)
c) d)
Hƣớng dẫn
a) Vì: Phương pháp dập lửa chủ yếu dựa theo nguyên tắc đẩy khí O2 ra khỏi vật liệu gây cháy
+ Nếu dùng N2: thỏa mãn yêu cầu vì N2 không duy trì sự cháy, nhưng N2 nhẹ hơn O2 (dN2/O2 = 28/32 < 1)
nên N2 không thể đẩy O2 bay lên phía trên mà N2 lại bay lên trước dập lửa không hiệu quả
Cần dùng CO2 vì CO2 không duy trì sự cháy và nặng hơn O2 nên có thể đẩy O2 ra khỏi vật gây cháy
b) Vì: + Quả bóng bơm khí CO2 thì không bay được vì CO2 nặng hơn không khí (dCO2/kk = 44/29 > 1)
+ Quả bóng bơm khí H2 thì bay được vì H2 nhẹ hơn không khí (dH2/kk = 2/29 < 1)
c) Vì: + Khi cháy, sinh ra khí độc: CO2, CO,.. là nguyên nhân chính gây tử vong
+ Nhiệt độ của đám cháy tập trung ở trần nhà
+ Cần bịt mũi, miệng bằng khăn ướt để tránh tiếp xúc với các khí độc và tránh bị bỏng
d) Vì: lượng oxi ở dưới giếng sâu, hầm mỏ rất ít
e) Vì: người ta nén khí CO2 vào chai nước ngọt ở áp suất cao để bảo quản nước rồi đóng nắp chai lại nên
khí CO2 tan và bão hòa vào nước ngọt Khi mở chai, áp suất trong chai giảm, độ tan CO2 giảm CO2
thoát ra khỏi chất lỏng nên sủi bọt
Bài 3. Giải thích trường hợp sau:
a) Hiện tượng khi quạt gió vào bếp củi vừa mới tắt?
b) Hiện tượng quạt gió vào ngọn nến đang cháy?
Hƣớng dẫn
a) Khi quạt gió vào bếp củi vừa bị tắt, lượng oxi tăng lên làm cho sự cháy diễn ra mạnh hơn và lửa sẽ
bùng cháy lên
b) Khi quạt gió vào ngọn nến đang cháy, nến tắt là do ngọn lửa của nến nhỏ nên khi quạt lượng gió vào
nhiều sẽ làm nhiệt độ hạ thấp đột ngột nên nến bị tắt
Bài 4. Vì sao khi đốt cồn (C2H5OH) thì thấy chát hết sạch, nhưng khi đốt củi, gỗ (chứa xenlulozo)
C6nH10nO5n và nhiều chất khác thì thấy còn lại rất nhiều tro?
Hƣớng dẫn
Gỗ có thành phần phức tạp, ngoài chất xơ là xenlulozo (chất dễ cháy) còn có các thành phần khác
không cháy hoặc chát tạo thành chất rắn như các hợp chất của kali, photpho, các chất khoáng khác Vì
vậy, khi đốt gỗ chỉ có phần xenlulozo (C6H10O5)n cháy hết sạch vì chỉ tạo Co2 và H2O
(C6H10O5)n + 6nO2
→ 6nCO2 + 5nH2O
Các thành phần khác trong gỗ không cháy hoặc cháy tạo ra sản phẩm là chất rắn (như K2CO3 )
nên ta thấy còn nhiều tro
Cồn là ancol etylic (C2H5OH) chỉ chứa các nguyên tố C, H, O nên khi đốt chỉ cho sản phẩm là CO2
và H2O, không có tro.
Bài 5. Cho các hình vẽ sau:
a/ Tìm ra các hình vẽ phù hợp có thể dùng để điều chế và thu được khí oxi tinh khiết mà vẫn đảm bảo
được an toàn. Viết PTHH xảy ra cho mỗi hình đã lựa chọn
b/ Trong các hình đã chọn, hình nào dùng để điều chế oxi nhanh và có hiệu quả? Vì sao?
c/ Tác dụng của MnO2 là gì?
d/ Khi thu đủ khí oxi, người tan tắt đèn cồn trước hay tháo ống dẫn khí trước? Vì sao?
e/ miếng bông ở miệng ống nghiệm có vai trò gì?
f/ Oxi được thu theo mấy phương pháp?
g/ Tại sao phải để ống nghiệm hơi trúc xuống dưới?
2. Giải thích tại sao sự cháy của cùng một chất khí diễn ra trong bình chứa khí oxi lại mãnh liệt hơn so với
khi diễn ra ngoài không khí.
Hƣớng dẫn
a/ Điều chế và thu được khí oxi tinh khiết mà vẫn đảm bảo được an toàn là: Hình 1+3+5+6+8
Hình 2: sai vì ống nghiệm cần trúc xuống
Hình 4: sai vì oxi nặng hơn không khí
Hình 7: sai vì ống dẫn khí không để vào ống nghiệm thu khí
b/ Hình dùng để điều chế oxi nhanh và có hiệu quả là: Hình 8 + Hình 6 + Hình 1 do có sử dụng chất xúc
tác MnO2 để phản ứng được xảy ra nhanh hơn
c/ MnO2 là chất xúc tác, có vai trò làm tốc độ tạo ra oxi nhanh hơn
d/ Khi pư kết thúc, ta tháo ống dẫn khí trước vì nếu tắt đèn cồn trước, nhiệt độ trong ống nghiệm giảm đột
ngột, áp suất giảm (nước bị hút ngược lại ống nghiệm) làm ống nghiệm dễ bị vỡ không an toàn
e/ Miếng bông có vai trò giữ cho hóa chất không bị trôi ra ngoài
f/ O2 được thu bằng 2 phương pháp: phương pháp đẩy nước và phương pháp đẩy không khí
g/ Vì KClO3 hoặc KMnO4 trong ptn thường không được khô, nên khi để trúc xuống thì hơi nước có sinh
ra sẽ không chảy xuống đáy bình an toàn
2. Vì khi cháy trong oxi, bề mặt tiếp xúc của chất cháy với oxi lớn hơn nhiều lần so với không khí. Khi
cháy trong không khí, thể tích oxi chỉ chiếm 1/5 thể tích, phần còn lại hầu hết là nito và các khí khác, bề
mặt tiếp xúc của chất cháy sẽ nhỏ hơn và một phần nhiệt bị tiêu hao do đốt nóng khí nito trong không khí.
Bài 6. Nêu hiện tượng và viết PTHH khi:
a) Đốt cháy sắt trong khí oxi b) Đốt cháy photpho trong khí c) Đốt cháy lưu huỳnh trong khí oxi
Hƣớng dẫn
a) Sắt cháy sáng chói và phản ứng làm nóng chảy đầu dây sắt thành giọt tròn, xuất hiện chất rắn màu nâu
là oxit sắt từ Fe3O4: 2O2 + 3Fe
→ Fe3O4
b) P cháy mạnh trong O2 với ngọn lửa sáng chói, tạo ra khói trắng dày là P2O5: 4P + 5O2
→ 2P2O5
c) S cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong oxi mãnh liệt hơn – ngọn lửa màu
xanh lam: S + O2
→ SO2
Bài 7.
Tìm CTHH ứng với các chất A, B, C, X, Y, Z cho phù hợp và hoàn thành PTHH theo sơ đồ sau:
X
( )
→ Y
( )
→ Z
( )
→ A
( )
→ B
( )
→ C
( )
→ B
Biết A là một kim loại được sử dụng nhiều trong lĩnh vực xây dựng, Y là đơn chất luôn cần cho sự cháy
và sự hô hấp.
Hƣớng dẫn
+ A là một kim loại được sử dụng nhiều trong lĩnh vực xây dựng A là sắt (Fe)
+ Y là đơn chất luôn cần cho sự cháy và sự hô hấp Y là oxi (O2)
(1) X có thể là KClO3 hoặc KMnO4
2KClO3
→ 2KCl + 3O2 hoặc (2KMnO4
→ K2MnO4 + MnO2 + O2)
(2) 2O2 + 3Fe
→ Fe3O4
(3) Fe3O4 + 4H2
→ 3Fe + 4H2O
(4) Fe + H2SO4 FeSO4 + H2
(5) 2H2 + O2
→ 2H2O (6) 2H2O
→ 2H2 + O2
Bài 8. Quan sát thí nghiệm như hình vẽ bên, Viết PTHH và giải thích:
a/ Không dùng tay (đặc biệt là tay ướt) để trực tiếp cầm viên kim loại
b/ Viên Na không được dùng quá to
c/ Tác dụng của chiếu phiễu trong lúc quan sát hiện tượng thí nghiệm
d/ Muốn thu khí tạo ra vào ống nghiệm phải để úp ống nghiệm.
Hƣớng dẫn
PTHH : 2Na + 2H2O 2NaOH + H2↑
Hiện tượng :
+ Natri pư mãnh liệt với nước, lăn tròn trên mặt nước
+ Giải phóng khí không màu
+ Có thể gây ra hiện tượng nổ
a/ Vì :
+ Da tay có mồ hôi (thành phần chính là nước) nên Na pư rất mãnh liệt với nước, tạo nhiệt
+ sản phẩm của phản ứng là NaOH, sẽ ăn mòn da tay
b/ Vì : pư sẽ nổ do
+ Na pư rất mạnh với nước, sinh ra nhiều nhiệt
+ tạo ra rất nhiều khí H2
Nhiệt cung cấp sẽ làm cho H2 sinh ra phản ứng với O2 trong không khí nổ
c/ + Tránh bị nổ vào mắt người quan sát
+ Hạn chế oxi tiếp xúc với H2 trong cốc
d/ Vì : H2 nhẹ hơn không khí (dH2/kk = 2/29 < 1) nên phải để úp ống nghiệm
Bài 9.
Khối lượng các chất lần lượt tăng hay giảm trong các thí nghiệm sau :
- Nung nóng một miếng Cu trong không khí
- Nung nóng một mẩu đá vôi trong không khí
Hƣớng dẫn
- Nung Cu trong không khí :
O2 + 2Cu
→ 2CuO
Ban đầu là Cu sau phản ứng là CuO Vậy khối lượng miếng đồng sau phản ứng tăng lên đúng bằng
lượng O2 phản ứng
- Nung nóng một mẩu đá vôi trong không khí
CaCO3
→ CaO + CO2 ↑
Ban đầu là CaCO3 sau phản ứng là CaO (bay mất khí CO2) nên sau phản ứng khối lượng giảm đi
(lượng giảm đi chính là lượng CO2 bay mất)
Bài 10.
Phản ứng của Fe với Oxi như hình vẽ sau:Vai trò của lớp nước ở đáy bình là:
Hƣớng dẫn
Tránh vỡ bình vì phản ứng tỏa nhiệt mạnh
Dạng IV. Hoàn thành sơ đồ phản ứng
a) KMnO4
→ O2
→ SO2
→ SO3
→ H2SO4
→ H2
→ H2O
→ NaOH
b) KClO3
→ O2
→ CaO
→ Ca(OH)2
→ CaCO3
c) Tìm CTHH ứng với các chất A, B, C, D cho phù hợp và hoàn thành PTHH cho mỗi trường hợp sau:
A
(1)
phaûnöùng phaânhuûy
B
(2)
phaûnöùnghoùahôïp
C
(3)
phaûnöùngtheá
D
(4)
phaûnöùngtheá
FeCl2
d)
e) Từ các chất KMnO4, Fe, Cu, dung dịch HCl, điều chế các chất cần thiết để thực hiện biến đổi
e1. Cu CuO Cu
e2. Fe Fe3O4 Fe
Hƣớng dẫn
a) 1. 2KMnO4
→ K2MnO4 + MnO2 + O2 4. SO3 + H2O → H2SO4
2. O2 + S
→ SO2 5. Fe + H2SO4 → FeSO4 + H2
3. 2SO2 + O2
→ 2SO3 6. 2H2 + O2
→ 2H2O
7. Na2O + H2O → 2NaOH
b) 1. 2KClO3
→ 2KCl + 3O2 2. Ca + O2
→ CaO
3. CaO + H2O → Ca(OH)2 4. Ca(OH)2 + CO2 → CaCO3 + H2O
c) (1) pư phân hủy duy nhất là pư điều chế ra oxi [Vậy A có thể là KClO3 hoặc KMnO4 / B là O2]
2KClO3
→ 2KCl + 3O2 hoặc (2KMnO4
→ K2MnO4 + MnO2 + O2)
(4) D
(4)
phaûnöùngtheá
FeCl2 [Chỉ có 1 pư thế duy nhất để tạo ra FeCl2 là: Fe + 2HCl FeCl2 + H2]
D bắt buộc phải là Fe C phải là hợp chất của Fe. Mặt khác, trước đó B là O2
Vậy:
(2) pư hóa hợp là: 2O2 + 3Fe
→ Fe3O4; (3) pư thế tạo ra Fe là: Fe3O4 + 4H2
→ 3Fe + 4H2O
d)
1. 2K + 2H2O 2KOH + H2 2. 2H2 + O2
→ 2H2O 3. 2H2O
→ 2H2 + O2
4. 2O2 + 3Fe
→ Fe3O4 5. Fe3O4 + 4H2
→ 3Fe + 4H2O 6. Fe + H2SO4 FeSO4 + H2
O2
sắt
than
Lớp nước
Tài liệu đính kèm:
 de_cuong_ly_thuyet_on_thi_hoc_sinh_gioi_hoa_hoc_lop_8_truong.pdf
de_cuong_ly_thuyet_on_thi_hoc_sinh_gioi_hoa_hoc_lop_8_truong.pdf



